Cellules souches et maladie de Parkinson
Des premières tentatives de transplantation aux espoirs 2025
Des premières tentatives de transplantation aux espoirs 2025
Trois articles publiés en 2025 dans des revues scientifiques prestigieuses relancent les discussions autour de la transplantation intracérébrale de cellules/tissus pour améliorer les symptômes de la maladie de Parkinson et essayer d’en ralentir la progression.
Une peu d’histoire avant de revenir sur ces derniers résultats.
1/ 1980 – 1990 : L’Ère des Tissus Fœtaux : Espoirs et enseignements
Nous le savons, la maladie de Parkinson se caractérise par la disparition progressive de neurones qui produisent la dopamine. Ce qui entraine une diminution de sa production. Pour rappel, la dopamine est essentielle, entre autres, à l’exécution des mouvements « automatiques », ceux que l’on accomplit tout au long de la journée s’en jamais y penser.
Dès les années 1980, les chercheurs ont exploré la transplantation comme traitement potentiel pour soigner la maladie. On connaissait précisément les cellules qui disparaissaient, il semblait donc évident et simple de pouvoir les remplacer. Au départ, l’idée était de remplacer les neurones dopaminergiques perdus par des nouveaux neurones obtenus à partir de tissus fœtaux. Cette approche se basait sur l’hypothèse que les neurones fœtaux pourraient survivre, s’intégrer et fonctionner en produisant de la dopamine dans le cerveau adulte. Plusieurs études cliniques ont été menées avec des résultats en « montagnes russes ». Parfois encourageants, parfois négatifs, mais surtout avec d’importantes limites.
Les études les plus notables ont été menées en Suède dans les années 1980 et 1990. Des personnes atteintes de la maladie de Parkinson ont reçu des transplantations de tissu cérébral fœtal riche en neurones dopaminergiques. Certains patients ont ainsi retrouvé une meilleure mobilité avec des effets positifs pouvant durer jusqu’à 10-15 ans ! Et cela s’accompagnait parfois d’une réduction de la prise orale des médicaments dopaminergiques. D’autres patients n’ont bénéficié d’aucun effet. Voire, ont développé des dyskinésies sévères, probablement par la présence de cellules produisant de la sérotonine, un autre neurotransmetteur*.
Les essais ont aussi révélé des limites majeures directement liées à l’utilisation de tissu fœtal. Ce qui dépend de dons rares et irréguliers et dont l’origine soulève d’importantes questions éthiques.
Toute recherche apporte des informations importantes, même si les résultats ne sont pas ceux espérés au départ. Ces travaux ont démontré que les cellules transplantées pouvaient survivre, s’intégrer et fonctionner dans un cerveau malade. Ils ont confirmé que restaurer la dopamine, pouvait, dans certains cas, améliorer les symptômes moteurs de la maladie de Parkinson. Cependant les tissus fœtaux, de qualité trop variable et éthiquement contestables, ne pouvaient devenir un traitement fiable et envisageable sur le long terme. Ces défis ont incité les chercheurs à explorer des alternatives, et ils se sont tournés vers les cellules souches.
2/ L’ère des cellules souches : une révolution en marche
Les années 2000 ont vu l’émergence des cellules souches comme une alternative prometteuse aux tissus fœtaux. Les cellules souches sont capables de se différencier en différents types de cellules, en particulier des cellules dopaminergiques. Elles présentent en théorie un potentiel illimité pour la transplantation. Les premières recherches ont porté sur les cellules souches d’origine embryonnaire qui ont la capacité de devenir des neurones dopaminergiques. Toutefois, leur utilisation soulève aussi des questions éthiques et des défis techniques. Comme par exemple le risque de rejet immunitaire et la formation de tumeurs.
L’arrivée des iPS
En 2006, la découverte des cellules souches pluripotentes induites, iPS, représente une avancée majeure dans le paysage de la transplantation pour la maladie de Parkinson. Les iPS sont des cellules reprogrammées « arrière » à partir de cellules adultes. En général, des cellules de la peau.
Pour mieux comprendre, lorsque l’on place une petite biopsie de la peau dans un liquide de culture, on observe d’abord la production et la multiplication de cellules de la peau, appelée fibroblastes. Lorsque l’on fournit à ces cellules des nutriments bien précis, elles vont perdre leur caractéristique « peau » et devenir un type de cellule plus anonyme. C’est-à-dire, sans identité précise, mais qui ont tout de même un potentiel multiple. Ces cellules dites pluripotentes peuvent, selon la nourriture que l’on va leur fournir, devenir n’importe quelle autre type de cellule du corps humain. Comme par exemple des cellules du foie, du cœur, des muscles, ou même du cerveau. Ces travaux ont principalement été initiés et conduits au Japon, mais aujourd’hui de nombreux laboratoires à travers le monde développent et utilisent les iPS.
Les iPS ont ouvert la voie à des applications thérapeutiques sans les problèmes éthiques associés aux cellules souches embryonnaires.
Les années 2010 ont été un tournant et le témoin de la mise en place de plusieurs essais cliniques qui utilisent des cellules souches, iPS et embryonnaires, pour le traitement la maladie de Parkinson.
3/ Où en est-on en 2025
L’année 2025 a été marquée par la publication des trois études majeures.
- Au Japon[1] , une étude pionnière est lancée à l’hôpital de Kyoto en 2018, et marque un tournant dans les études de transplantation qui utilise des iPS.
- En parallèle aux Etats Unis[2] , une étude utilise des cellules appelées bemdaneprocel.
- Une dernière étude nommée TransEuro[3] , menée en Suède et en Grande Bretagne, visait à évaluer l’efficacité et la sécurité de la transplantation, non pas de cellules souches mais de tissu mésencéphalique ventral fœtal humain. C’est un peu un retour aux années 80.
| Kyoto (Japon) [1] | Bemdaneprocel (US)[2] | TransEuro (Suède et GB)[3] | |
|---|---|---|---|
| Type d’étude | Phase I/II | Phase I | Non applicable |
| Durée de l’étude (suivi) | 24 mois | 18 mois | 36 mois |
| Type de cellules | iPS | Cellules souche embryonnaire | Tissus mésencéphaliques fœtaux |
| Site de transplantation | Putamen des deux hémisphères | Putamen des deux hémisphères | Putamen des deux hémisphères |
| Nombre de cellules par hémisphère | Deux doses : 2.1-2.3 millions 5.3-5.5 millions | Deux doses : 0.9 millions 2.7 millions | Une dose |
| Nombre de personnes | 7 (3/4) | 12 (5/7) | 11 |
| Durée de maladie des personnes transplantées | Au moins 5 ans, avec complications motrices | 3-20 ans, avec complications motrices | 2-15 ans, sans dyskinésies majeures |
| Immunosuppression | 15 mois | 12 mois | 12 mois |
| Imagerie cérébrale | PET scan | PET scan | PET scan |
[2] Tabar et al. Nature. 2025 May;641(8064):978-983.
[3] Barker et al. Nat Biotechnol. 2025 May 2.
Ce qu’il faut retenir des études
Les trois études sont méthodologiquement similaires et offrent des perspectives différentes sur l’utilisation de différentes sources de cellules pour la transplantation dans le traitement de la maladie de Parkinson.
- Les trois études montrent que la procédure de transplantation est sûre et bien tolérée. Et ce, sans effets indésirables graves.
- Les transplants survivent dans le cerveau et peuvent faire des connexions avec les autres cellules (mise en évidence par l’imagerie cérébrale).
- L’étude TransEuro indique toutefois une faible survie des tissus transplantés et l’absence d’effet symptomatique bénéfique. De plus, l’utilisation de tissue fœtal humain pose toujours des problèmes éthiques. En plus des problèmes éthiques, s’ajoutent des problèmes pratiques, ce qui rend la standardisation difficile, ainsi que le contrôle de qualité de préparation des tissus.
- L’étude japonaise et américaine suggère une amélioration des symptômes moteurs.
- Les trois études sont en « ouverts » (open label), c’est-à-dire que les patients savent qu’ils ont reçu un traitement qui peut potentiellement améliorer leur condition. Les améliorations liées à un possible effet placebo ne sont donc pas contrôlés et pourraient biaiser les résultats observés.
En conclusion
En conclusion, les iPS (Japon) et les cellules souches embryonnaires humaines (US) semblent être des options plus viables pour les thérapies futures. Ce qui offre un espoir pour les personnes atteintes de la maladie de Parkinson. Les résultats de ces études ne permettent pas d’affirmer l’efficacité de ce type de transplantation. Cependant, cela encourage la poursuite des recherches et des essais cliniques pour évaluer davantage l’efficacité et la sécurité à long terme de ces approches thérapeutiques.
Bon à savoir – Point de réflexion
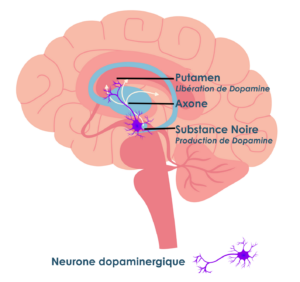
Comme on l’a vu dans les trois études décrites ci-dessus, les transplantations s’effectuent dans le putamen (striatum). Le putamen est la zone du cerveau où la dopamine se libère et s’utilise. TOUTEFOIS, celle-ci se produit dans une autre zone du cerveau, la substance noire. C’est là que la production et libération de la dopamine est régulée.
Il est donc important de noter que transplanter des cellules qui produisent la dopamine dans le putamen peut améliorer les symptômes moteurs en restaurant partiellement les niveaux de dopamine. En revanche, cela ne permet pas de rétablir pleinement le circuit neuronal normal.
Pourquoi le résultat n’est que partiel ?
Les neurones dopaminergiques ont des longs bras, qu’on appelle axones. Ils s’étendent de la substance noire vers le putamen. C’est le long de ces bras que la dopamine est transportée et libérée. Le chemin que suit ces bras s’établit pendant le développement embryonnaire, qui suit des signaux moléculaires précis. Facteurs de croissance, molécules d’adhésion, gradients chimiques. Cela n’est plus possible dans un cerveau adulte. Les axones établissent des connexions spécifiques et organisées, et permettent une libération fine et régulée de dopamine. Régulation qui se fait principalement au niveau de la substance noire.
En revanche, lors d’une greffe des cellules dans le putamen adulte, les cellules transplantées peuvent refaire de connexion avec les autres cellules qui les entourent. Néanmoins la libération de la dopamine ne se régule pas de façon physiologique et n’est donc pas vraiment contrôlée.
Les cellules transplantées dans le putamen agissent comme des « producteurs de dopamine ». Mais pas comme un remplacement neuronal complet. En effet, elles produisent et libèrent de la dopamine localement, ce qui compense en partie le déficit, et ce qui peut améliorer certains symptômes moteurs (rigidité, lenteur). Cependant, cela ne restaure pas la dynamique naturelle de libération de dopamine.
Mais alors pourquoi ne pas greffer directement dans la substance noire ?
Transplanter des neurones dans la substance noire serait théoriquement idéal pour reconstituer le circuit. Mais, en l’absence des signaux qui guident la croissance des axones dans le cerveau adulte ; ceux-ci ne retrouveraient pas leur chemin vers le putamen. De plus, l’environnement adulte est inhibiteur pour la repousse axonale, et la survie des cellules transplantées est meilleure dans le striatum (meilleure vascularisation, moins de stress).